LM11A-31 약물, 임상시험에서 알츠하이머병 진행을 늦춘다
최근 리뷰 : 02.07.2025
 ">
">Nature Medicine 저널 에 최근 게재된 연구에서 과학자들은 p75 신경영양인자 수용체(p75NTR) 조절을 통해 알츠하이머병(AD) 치료에 있어 LM11A-31의 안전성과 효능을 조사하기 위해 무작위 이중맹검 위약대조 2a상 연구를 수행했습니다.
후기 발병 알츠하이머병(Late-onset AD)은 시냅스 기능 부전, 퇴화, 그리고 신경 세포 소실을 특징으로 하는 가장 흔한 치매 형태입니다. 알츠하이머병 치료에 사용되는 두 가지 주요 약물은 비정상적인 아밀로이드 베타 또는 타우 단백질의 축적을 표적으로 삼지만, 병태생리의 일부만을 다룹니다. 또 다른 접근법은 근본적인 생물학적 경로에 영향을 미치는 수용체와 신호 전달 네트워크를 표적으로 삼는 것입니다. 전임상 연구에 따르면, 새로운 소분자 LM11A-31을 이용하여 p75NTR을 조절하면 아밀로이드 및 비정상적인 타우 단백질로 인한 시냅스 손실을 줄일 수 있는 것으로 나타났습니다.
연구 설명
이 무작위 임상 시험에서 연구진은 LM11A-31이 인간의 p75NTR을 조절하여 알츠하이머병의 진행을 늦출 수 있는지 조사했습니다.
연구 참여자들은 경증에서 중등도의 천식 환자 242명에게 LM11A-31 경구 캡슐 200mg 및 400mg 또는 위약을 1:1:1 비율로 26주 동안 투여받았습니다. 참여자들은 생물학적으로 알츠하이머병이 확진된 환자(뇌척수액 아밀로이드 베타 단백질 42(Aβ42) 수치가 550ng/L 미만이거나 Aβ42:β40 비율이 0.89 미만)였으며, 맥칸(McKhann) 진단 기준에 따라 간이정신진단(MMSE) 점수가 18~26점, 노인우울척도(GDS) 점수가 5.0 미만, 변형 하친스키 허혈척도(HIS) 점수가 4.0 이하, 정규 교육 기간이 8년 이상이며, 인지 기능 저하가 6개월 이상인 환자였습니다.
적격 참가자는 연구 참여 전 3개월 이상 아세틸콜린에스테라아제 억제제(AChEI) 또는 부분 NMDA 수용체 길항제를 복용했습니다. 항정신병제, 벤조디아제핀, 항경련제, 진정제, 중추신경계 활성 항고혈압제, 뇌신경자극제(은행잎 추출물 제외), 또는 오피오이드 함유 진통제와 같은 불법 약물은 복용하지 않았습니다.
이 연구의 주요 결과는 안전성과 내약성으로, 컬럼비아 자살 생각 및 행동 심각도 평가 척도(C-SSRS), 활력 징후, 혈압, 혈액학적 지표를 사용하여 평가했습니다. 2차 인지 기능 결과를 평가하기 위해 구조적 자기공명영상(cMRI), 플루오로디옥시포도당 양전자방출단층촬영(FDG-PET), 뇌척수액(CSF) 바이오마커를 사용했습니다. 알츠하이머병 측정에는 Thr181-인산화 타우, 총 타우 단백질, Aβ40, Aβ42, 그리고 AChE 활성도가 포함되었습니다. 연구팀은 맞춤형 신경심리학적 검사를 사용하여 기준 시점, 12주차, 그리고 26주차에 2차 인지 기능 결과를 평가했습니다.
연구 결과
이 연구에서 LM11A-31은 안전하고 내약성이 우수하며, 유의미한 안전성 문제는 없는 것으로 나타났습니다. 가장 흔한 부작용으로는 두통, 설사, 호산구증가증, 비인두염이 있었으며, 위장관 문제와 호산구증가증이 치료 중단의 주요 원인이었습니다. 200mg군과 위약군에 비해 400mg군에서 치료 중단 사례가 더 많았습니다. MRI 검사 결과 아밀로이드 관련 이상을 포함한 안전성 문제는 발견되지 않았습니다. 두 치료군 간에 인지 점수나 아밀로이드 이상에 유의미한 차이는 없었습니다.
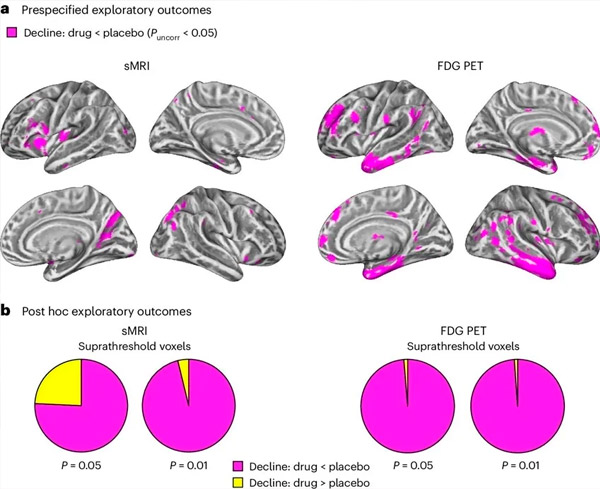
A. 이원 혼합 모형 공분산 분석을 통해 치료(약물 또는 위약)와 시간(치료 전 또는 치료 후) 간의 상호작용을 조사했습니다. 상호작용 가설(약물이 위약에 비해 진행을 늦춘다)을 조사하는 단측 t-대조 분석 결과, LM11A-31 치료가 약물군(cMRI, n = 127; PET, n = 121)에서 위약군(cMRI, n = 66; PET, n = 62)에 비해 종단적 퇴행(좌측 패널)과 포도당 대사 저하(우측 패널)를 늦추는 것으로 나타났습니다. 이러한 상호작용을 보여주는 복셀은 개체군별 피질 표면의 보정되지 않은 임계값인 P < 0.05(자홍색)에서 표시됩니다. 좌반구와 우반구는 각각 위쪽과 아래쪽 행에 표시됩니다. 가설과 일치하지 않는 상호작용을 보이는 뇌 영역은 보충 자료의 그림 7에 나와 있습니다.
B. 사전 정의된 취약한 AD 뇌 영역의 총 폭셀 수(파이 차트의 전체 면적)는 가설과 일치하는 상호작용(자홍색) 또는 가설과 일치하지 않는 상호작용(노란색)을 보이며, 각 영상 방식(cMRI, 왼쪽 패널; FDG PET, 오른쪽 패널)에서 보정되지 않은 P < 0.01 및 P < 0.05의 임계값이 점차 확대됨에 따라 나타납니다. 몬테카를로 시뮬레이션 결과, 가설과 일치하는 효과를 보이는 폭셀과 가설과 일치하지 않는 효과를 보이는 폭셀의 비율이 cMRI 및 PET 모두에서 무작위 생성 데이터를 기반으로 관찰된 것보다 유의미하게 높았습니다(각 방식에서 P < 0.001, 양측 검정).
LM11A-31은 위약군에 비해 뇌척수액 Aβ42와 Aβ40의 증가를 효과적으로 감소시켰습니다. 또한, 이 약물은 시냅스전 단백질 바이오마커인 SNAP25의 연간 중앙값 변화율(median annual percentage change)을 감소시켰고, 시냅스후 바이오마커인 NG도 감소시켜 시냅스전 및 시냅스후 연결 손실이 지연되었음을 나타냈습니다. LM11A-31은 또한 YKL40의 증가를 감소시켜 MMSE 점수를 감소시키고 ADAS-Cog-13 점수를 증가시켰습니다. 또한, 이 약물은 전두엽과 후두정엽 피질의 회백질 손실을 감소시켰고, 내후각 피질, 측두 피질, 해마, 섬 피질, 전전두엽 피질 등의 영역에서 포도당 대사 감소를 보였습니다.
결론
이 연구는 LM11A-31에 의한 p75NTR 조절이 대규모 임상 시험에 적합하다는 결론을 내렸습니다. LM11A-31은 일차 안전성 평가변수를 충족했으며, 경증에서 중증 알츠하이머병(AD) 환자에서 내약성이 우수했습니다. 이러한 결과는 알츠하이머병에서 질병 조절 치료제로서 p75NTR을 조절할 수 있는 소분자 약물의 잠재력을 평가하기 위해 더 긴 치료 기간을 가진 추가 연구가 필요함을 시사합니다. 이 연구는 LM11A-31이 Aβ40, Aβ42, SNAP25, NG, YKL40을 포함한 여러 바이오마커에 유의미한 영향을 미쳐 병리학적 진행을 늦추는 것으로 나타남을 보여주었습니다. 향후 연구에서는 신경교세포 건강 지표를 추가로 평가할 수 있을 것입니다.

