난소
기사의 의료 전문가
최근 리뷰 : 04.07.2025

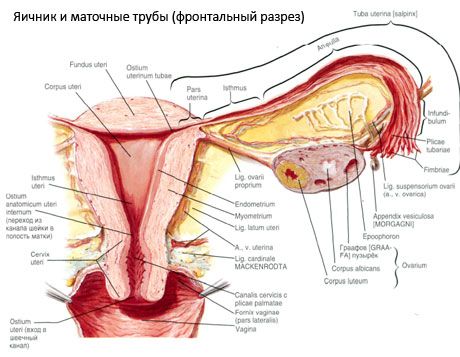
난소(ovarium; 그리스어 oophoron)는 한 쌍의 기관으로, 자궁의 넓은 인대 뒤 골반강에 위치한 여성 생식선입니다. 난소에서 여성 생식 세포(난자)가 발달하고 성숙하며 혈액과 림프로 들어가는 여성 성호르몬이 형성됩니다. 난소는 타원형이며 앞뒤로 다소 납작합니다. 난소의 색깔은 분홍색입니다. 출산한 여성의 난소 표면에는 배란과 황체 변형의 흔적인 함몰과 흉터가 보입니다. 난소의 무게는 5~8g입니다. 난소의 크기는 길이 2.5~5.5cm, 너비 1.5~3.0cm, 두께 최대 2cm입니다. 난소에는 두 개의 자유면이 있습니다. 골반강을 향하고 나팔관으로 부분적으로 덮여 있는 내측면(facies medialis)과 골반 측벽에 인접하여 약간 움푹 들어간 부분인 난소와(ovarian fossa)에 인접한 외측면(facies lateralis)입니다. 이 난소와(ovarian fossa)는 위쪽은 복막으로 덮여 있고 아래쪽은 자궁동맥과 폐쇄동맥이 만나는 모서리에 위치합니다. 난소 뒤쪽으로는 해당 쪽의 요관이 위에서 아래로 복막후를 통과합니다.
난소의 표면은 앞쪽에서 볼록한 자유 가장자리(후방)(margo liber)로 이어지고, 장간막 가장자리(margo mesovaricus)로 이어지며, 복막의 짧은 주름(난소 장간막)을 통해 자궁의 넓은 인대의 뒤쪽 엽에 연결됩니다. 이 기관의 전방 가장자리에는 홈이 있는 함몰부인 난소 문(hilum ovarii)이 있는데, 이곳을 통해 동맥과 신경이 난소로 들어가고 정맥과 림프관이 나옵니다. 난소에는 또한 두 개의 끝이 있습니다. 나팔관을 마주보는 둥근 위쪽 관 모양 끝(extremitas tubaria)과 난소 인대(lig. ovarii proprium)를 통해 자궁에 연결된 아래쪽 자궁 끝(extremitas utenna)입니다. 이 인대는 두께가 약 6mm인 둥근 끈 형태로 난소의 자궁 끝에서 자궁의 측면 모서리까지 이어지며 자궁의 넓은 인대의 두 잎 사이에 위치합니다.난소의 인대 장치에는 난소의 현수 인대(lig.suspensorium ovarii)도 포함됩니다.난소는 작은 골반 벽에서 난소까지 이어지는 복막의 주름이며 내부에 난소 혈관과 섬유질 섬유 다발을 포함합니다.난소는 짧은 장간막(mesovarium)에 의해 고정됩니다.장간막은 자궁의 넓은 인대의 뒤쪽 엽에서 난소의 장간막 가장자리까지 이어지는 복막의 복제입니다.난소 자체는 복막으로 덮여 있지 않습니다.나팔관의 가장 큰 난소 가장자리는 난소의 관형 끝에 붙어 있습니다. 난소의 지형은 자궁의 위치와 크기(임신 중)에 따라 달라집니다. 난소는 작은 골반강에 위치한 매우 이동성이 높은 기관입니다.
난소의 혈관과 신경
난소로의 혈액 공급은 aa. et vv. ovaricae et uterinae에 의해 제공됩니다.두 개의 난소 동맥(aa. ovaricae dextra et sinistra)은 신동맥 바로 아래 대동맥의 전면에서 시작됩니다.오른쪽 동맥은 보통 대동맥에서 시작하고 왼쪽 동맥은 신동맥에서 시작합니다.각 난소 동맥은 대요근의 전면을 따라 아래쪽과 측면으로 향하며 앞쪽에서 요관을 가로질러(가지를 내보냄), 외부 장골 혈관, 경계선을 지나 골반강으로 들어가 난소의 현수 인대에 위치합니다.내측 방향으로 따라가면 난소 동맥은 나팔관 아래 자궁의 넓은 인대 잎 사이를 지나 가지를 내보낸 다음 난소의 장간막으로 들어갑니다.난소의 문부로 들어갑니다.
난소 동맥의 분지는 자궁 동맥의 난소 분지와 넓게 문합됩니다. 난소에서 나오는 정맥 유출은 주로 난소 문부(hilum) 부위에 위치한 난소 정맥총으로 이루어집니다. 여기에서 혈액 유출은 자궁 정맥과 난소 정맥, 두 방향으로 흐릅니다. 오른쪽 난소 정맥에는 판막이 있어 하대정맥으로 흐릅니다. 왼쪽 난소 정맥은 판막이 없지만 왼쪽 신정맥으로 흐릅니다.
난소에서 림프액 배액은 림프관을 통해 이루어지며, 특히 난소하 림프총이 있는 기관문 부위에서 많이 발생합니다. 이후 림프액은 난소 림프관을 따라 대동맥주위 림프절로 배출됩니다.
난소의 신경 지배
교감신경 - 복강신경(태양신경), 상위 장간막신경 및 하복부신경총에서 나오는 신경절 후 섬유에 의해 제공됩니다. 부교감신경 - 장골 신경에 의해 제공됩니다.
난소의 구조
난소 표면은 단층의 배아 상피로 덮여 있습니다. 그 아래에는 치밀한 결합 조직 단백질 외피(백막)가 있습니다. 난소의 결합 조직은 탄성 섬유가 풍부한 기질(난소 기질)을 형성합니다. 난소의 실질인 난소 실질은 외층과 내층으로 나뉩니다. 난소 중앙, 난소문에 더 가까운 내층을 수질(난소 수질)이라고 합니다. 이 층은 느슨한 결합 조직으로 이루어져 있으며, 수많은 혈관과 림프관, 신경이 분포합니다. 난소의 외층인 피질(난소 피질)은 더 치밀합니다. 여기에는 성숙한 일차 난포(folliculi ovarici primarii), 이차(소포성) 난포(folliculi ovarici secundarii, s.vesiculosi), 성숙한 난포, Graafian 난포(folliculi ovarici maturis), 노란색 및 폐쇄체가 있는 많은 결합 조직이 포함되어 있습니다.
각 난포에는 여성 생식 난자, 즉 난모세포(난세포)가 들어 있습니다. 난자는 지름이 최대 150µm에 달하는 둥글고, 핵과 다량의 세포질을 가지고 있으며, 세포 소기관 외에도 난자의 영양 공급에 필요한 단백질-지질 함유물(노른자)과 글리코겐을 함유하고 있습니다. 난자는 보통 배란 후 12~24시간 이내에 영양분을 모두 소모합니다. 수정이 이루어지지 않으면 난자는 죽습니다.
인간의 난자는 두 개의 막으로 덮여 있습니다. 안쪽에는 난자의 세포질막인 세포막이 있습니다. 세포막 바깥쪽에는 난포세포라고 불리는 층이 있는데, 이 세포막은 난자를 보호하고 호르몬 생성 기능, 즉 에스트로겐을 분비하는 기능을 합니다.
자궁, 난관, 난소의 생리학적 위치는 복막, 인대, 골반 조직을 연결하는 지지, 고정, 지지 기구에 의해 제공됩니다. 지지 기구는 쌍을 이루는 형태로 나타나며, 자궁의 원형 인대와 광인대, 난소의 고유 인대, 그리고 현수 인대를 포함합니다. 자궁의 광인대, 난소의 고유 인대, 그리고 현수 인대는 자궁을 중간 위치에 고정합니다. 원형 인대는 자궁 저부를 앞으로 당겨 생리학적으로 기울어지게 합니다.
고정(앵커링) 장치는 자궁을 소골반 중앙에 위치시켜 좌우, 앞뒤로 움직이는 것을 사실상 불가능하게 합니다. 그러나 인대 장치는 자궁 하부에서 떨어져 있기 때문에 자궁이 여러 방향으로 기울어질 수 있습니다. 고정 장치는 골반의 느슨한 조직에 위치하며 자궁 하부에서 골반의 외측, 전방, 후방 벽까지 뻗어 있는 인대, 즉 천골인대, 주인대, 자궁방광인대, 방광치골인대를 포함합니다.
중배엽 외에도 다음과 같은 난소 인대가 구별됩니다.
- 난소의 현수 인대는 이전에 누두골반인대(infundibulopelvic ligament)로 불렸습니다. 이는 복막의 주름으로, 혈관(a. et v. ovarica)과 림프관, 그리고 난소 신경이 통과하며, 골반 외벽, 요추 근막(총장골동맥이 외측과 내측으로 나뉘는 부위), 그리고 난소의 상부(난관) 말단 사이에 뻗어 있습니다.
- 난소 고유인대는 넓은 자궁인대 잎 사이, 뒷잎에 더 가까운 곳을 지나 난소의 아래쪽 끝을 자궁의 외측 가장자리와 연결합니다. 난소 고유인대는 나팔관 시작 부분과 원형인대 사이, 원형인대 뒤쪽 위쪽에서 자궁에 부착됩니다. 인대 굵기에는 자궁동맥의 말단 분지인 난소동맥이 지나갑니다.
- 부속난소인대(appendicular-ovarian ligament)는 부속장기(appendix)의 장간막에서 우측 난소 또는 자궁의 광인대(wide ligament)까지 복막 주름 형태로 뻗어 있습니다. 이 인대는 불변성이며 여성의 1/2~1/3에서 관찰됩니다.
지지 장치는 골반저 근육과 근막으로 표현되며, 아래쪽, 중간, 위쪽(내부) 층으로 나뉩니다.
가장 강력한 근육은 항문을 들어 올리는 한 쌍의 근육으로 대표되는 위쪽(안쪽) 근육층입니다. 이 근육층은 꼬리뼈에서 골반뼈까지 세 방향(치골미골근, 장골미골근, 좌골미골근)으로 퍼져 나가는 근육 다발로 구성됩니다. 이 근육층은 골반 횡격막이라고도 합니다.
중간층 근육은 결합골, 치골, 그리고 좌골 사이에 위치합니다. 중간층 근육인 비뇨생식기 횡격막은 요도와 질이 통과하는 골반 출구의 앞쪽 절반을 차지합니다. 횡격막 사이의 앞쪽 부분에는 요도의 외괄약근을 형성하는 근육 다발이 있고, 뒤쪽 부분에는 회음부를 가로지르는 심부횡근이 있습니다.
골반저 근육의 아랫부분(바깥쪽)은 숫자 8과 비슷한 모양을 한 표층 근육으로 이루어져 있습니다. 여기에는 구근해면체근, 좌골해면체근, 외항문괄약근, 표층횡회음근이 포함됩니다.
난소의 발생
난포 성장 및 폐쇄 과정은 임신 20주에 시작되며, 분만 시에는 최대 200만 개의 난자가 여아의 난소에 남아 있습니다. 초경이 되면 난포의 수는 30만 개로 감소합니다. 생식 기간 전체 동안 최대 500개의 난포만이 성숙하여 배란합니다. 난포의 초기 성장은 FSH 자극에 의존하지 않으며 제한적이며, 폐쇄는 빠르게 발생합니다. 스테로이드 호르몬 대신 국소 자가분비/측분비 펩타이드가 원발성 난포의 성장 및 폐쇄를 주요 조절하는 것으로 여겨집니다. 난포 성장 및 폐쇄 과정은 어떤 생리적 과정에 의해서도 방해받지 않는 것으로 여겨집니다. 이 과정은 자궁 내 기간과 폐경을 포함한 모든 연령대에서 계속되며, 임신, 배란, 무배란에 의해 중단됩니다. 각 주기에서 난포의 성장과 그 수를 유발하는 기전은 아직 명확하지 않습니다.
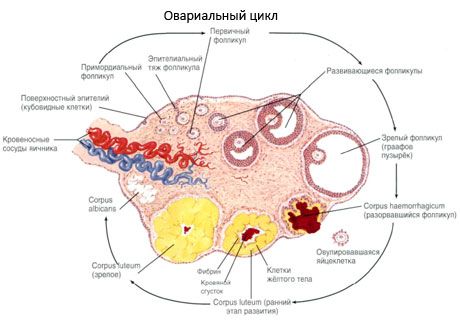
난포는 발달 과정에서 여러 단계의 발달을 거칩니다. 원시 생식 세포는 난황낭 내배엽인 요막에서 기원하여 임신 5~6주에 배아의 생식기로 이동합니다. 임신 6~8주에서 16~20주까지 지속되는 빠른 체세포 분열의 결과로, 배아의 난소에서 최대 600만~700만 개의 난모세포가 형성되고, 얇은 과립막 세포층으로 둘러싸여 있습니다.
전강난포 - 난모세포는 투명대(zona pellucida)로 둘러싸여 있습니다. 난모세포를 둘러싼 과립막세포가 증식하기 시작하며, 이들의 성장은 생식선자극호르몬(gonadotropin)에 의존하고 에스트로겐 수치와 상관관계를 보입니다. 과립막세포는 FSH의 표적이 됩니다. 전강난포 단계에서 과립막세포는 세 가지 종류의 스테로이드를 합성할 수 있습니다. 1. 주로 안드로겐을 에스트라디올로 전환하는 주요 효소인 아로마타제의 활성을 유도합니다. 에스트라디올은 자체 수용체의 수를 증가시켜 FSH와는 독립적으로 과립막세포에 직접적인 유사분열 효과를 발휘하는 것으로 알려져 있습니다. 에스트라디올은 방향족화 과정의 활성화를 포함하여 FSH의 효과를 증진시키는 측분비 인자로 간주됩니다.
FSH 수용체는 난포 성장이 시작되는 즉시 과립막 세포막에 나타납니다. FSH의 감소 또는 증가는 수용체 수의 변화를 초래합니다. FSH의 이러한 작용은 성장 인자에 의해 조절됩니다. FSH는 G-단백질, 즉 아데닐산 고리화효소 시스템을 통해 작용합니다. 난포의 스테로이드 생성은 주로 FSH에 의해 조절되지만, 이 과정에는 이온 채널, 티로신 키나제 수용체, 제2 전달물질인 인지질분해효소 시스템 등 여러 요인이 관여합니다.
초기 난포 발달에서 안드로겐의 역할은 복잡합니다. 과립막 세포는 안드로겐 수용체를 가지고 있습니다. 이 수용체는 FSH에 의해 유도되는 에스트로겐으로의 방향족화의 기질일 뿐만 아니라, 저농도에서도 방향족화를 촉진할 수 있습니다. 안드로겐 수치가 증가하면, 전강 과립막 세포는 에스트로겐으로의 방향족화 경로가 아닌, 5α-환원효소를 통한 더 간단한 안드로겐 경로를 우선적으로 선택하여 에스트로겐으로 전환될 수 없는 안드로겐으로 전환함으로써 아로마타제 활성을 억제합니다. 이 과정은 또한 FSH와 LH 수용체 형성을 억제하여 난포 발달을 중단시킵니다.
방향족화 과정, 즉 안드로겐 수치가 높은 난포는 폐쇄 과정을 겪습니다. 난포의 성장과 발달은 안드로겐을 에스트로겐으로 전환하는 능력에 달려 있습니다.
FSH가 존재할 경우, 난포액의 주요 물질은 에스트로겐입니다. FSH가 없을 경우, 안드로겐입니다. 황체형성호르몬(LH)은 일반적으로 주기 중반까지 난포액에 존재하지 않습니다. LH 수치가 증가하면 과립막 세포의 유사분열 활동이 감소하고 퇴행성 변화가 나타나며 난포의 안드로겐 수치가 증가합니다. 난포액의 스테로이드 수치는 혈장보다 높으며, 이는 난소 세포인 과립막 세포와 난포막 세포의 기능적 활동을 반영합니다. FSH의 유일한 표적이 과립막 세포라면, LH는 난포막 세포, 기질 세포, 황체 세포, 과립막 세포 등 여러 표적을 갖습니다. 과립막 세포와 난포막 세포 모두 스테로이드 생성 능력을 가지고 있지만, 아로마타제 활성은 과립막 세포에서 우세합니다.
LH에 반응하여 테카 세포는 안드로겐을 생성하고, 이 안드로겐은 FSH에 의해 유도되는 방향족화를 통해 과립세포에 의해 에스트로겐으로 전환됩니다.
난포가 성장함에 따라 테카 세포는 LH 수용체, P450 sec 및 3베타-하이드록시스테로이드 탈수소효소, 인슐린 유사 성장 인자(IGF-1)에 대한 유전자를 발현하기 시작하여 LH와 상승적으로 작용하여 유전자 발현을 증가시키지만 스테로이드 생성을 자극하지는 않습니다.
난소 스테로이드 생성은 항상 황체형성호르몬(LH)에 의존합니다. 난포가 성장함에 따라, 테카 세포는 콜레스테롤로부터 안드로겐을 생성하는 P450c17 효소를 발현합니다. 과립막 세포는 이 효소를 가지고 있지 않으며, 안드로겐으로부터 에스트로겐을 생성하기 위해 테카 세포에 의존합니다. 스테로이드 생성과 달리, 난포 생성은 FSH에 의존합니다. 난포가 성장하고 에스트로겐 수치가 증가함에 따라, 피드백 메커니즘이 활성화됩니다. FSH 생성이 억제되고, 이는 난포의 아로마타제 활성을 감소시키고, 궁극적으로 세포자멸사(프로그램된 세포 사멸)를 통해 난포 폐쇄를 초래합니다.
에스트로겐과 FSH의 피드백 기전은 성장하기 시작한 난포의 발달을 억제하지만, 우성 난포의 발달은 억제하지 않습니다. 우성 난포는 더 많은 FSH 수용체를 포함하고 있으며, 이는 과립막 세포의 증식과 안드로겐의 에스트로겐으로의 방향족화를 지원합니다. 또한, 측분비 경로와 자가분비 경로는 동난포 발달의 중요한 조절자 역할을 합니다.
자가분비/측분비 조절제는 인히빈, 액티빈, 폴리스타틴과 같은 펩타이드로 구성되며, 이 펩타이드는 FSH에 반응하여 과립막 세포에서 합성되어 난포액으로 유입됩니다. 인히빈은 FSH 분비를 감소시키고, 액티빈은 뇌하수체에서 FSH 분비를 자극하여 난소에서 FSH의 작용을 강화합니다. 폴리스타틴은 액티빈과 결합하여 FSH 활성을 억제할 수 있습니다. 배란 및 황체 발달 후, 인히빈은 황체형성호르몬(LH)의 조절을 받습니다.
난소 세포의 성장과 분화는 인슐린 유사 성장 인자(IGE)의 영향을 받습니다. IGF-1은 과립막 세포에 작용하여 고리형 아데노신 일인산(cAMP), 프로게스테론, 옥시토신, 프로테오글리칸, 인히빈의 생성을 증가시킵니다.
IGF-1은 테카 세포에 작용하여 안드로겐 생성을 증가시킵니다. 테카 세포는 다시 종양괴사인자(TNF)와 상피세포성장인자(EGF)를 생성하는데, 이 역시 FSH에 의해 조절됩니다.
EGF는 과립막세포의 증식을 촉진합니다. IGF-2는 모낭액의 주요 성장인자이며, IGF-1, TNF-a, TNF-3, EGF도 함유되어 있습니다.
난소 기능의 부신피질자극호르몬 및/또는 자가분비 조절 장애는 배란 장애와 다낭성 난소 발달에 영향을 미치는 것으로 보입니다.
난포동이 성장함에 따라 난포액 내 에스트로겐 함량이 증가합니다. 에스트로겐 증가가 정점에 도달하면 과립막 세포에 황체형성호르몬(LH) 수용체가 나타나 과립막 세포의 황체화가 일어나고 프로게스테론 생성이 증가합니다. 따라서 배란 전 기간에 에스트로겐 생성 증가는 LH 수용체의 출현을 유발하고, LH는 다시 과립막 세포의 황체화와 프로게스테론 생성을 유발합니다. 프로게스테론 증가는 에스트로겐 수치를 감소시키고, 이는 주기 중간에 FSH의 두 번째 정점을 유발하는 것으로 보입니다.
배란은 황체형성호르몬(LH) 분비 정점 후 10~12시간, 에스트라디올 분비 정점 후 24~36시간에 일어나는 것으로 알려져 있습니다. LH는 난자의 환원 분열, 과립세포의 황체형성, 그리고 난포에서 프로게스테론과 프로스타글란딘의 합성을 자극하는 것으로 알려져 있습니다.
프로게스테론은 단백질 분해 효소의 활성을 증가시키는데, 이 효소는 프로스타글란딘과 함께 난포벽 파열에 관여합니다. 프로게스테론에 의해 유도되는 FSH 최고치는 플라스미노겐을 단백질 분해 효소인 플라스민으로 전환시켜 난자가 난포를 빠져나올 수 있도록 하고, 황체기의 정상적인 발달에 필요한 충분한 수의 LH 수용체를 제공합니다.
배란 후 3일 이내에 과립막 세포가 커지고 색소인 루테인으로 채워진 특징적인 액포가 나타납니다. 테카-황체 세포는 테카와 기질에서 분화되어 황체의 일부가 됩니다. 황체를 관통하는 모세혈관은 혈관신생 인자의 영향으로 매우 빠르게 발달하고, 혈관신생이 개선됨에 따라 프로게스테론과 에스트로겐 생성이 증가합니다. 스테로이드 생성 활동과 황체의 수명은 LH 수치에 따라 결정됩니다. 황체는 균질한 세포 형성이 아닙니다. 두 종류의 황체 세포 외에도 내피 세포, 대식세포, 섬유아세포 등이 포함되어 있습니다. 큰 황체 세포는 펩타이드(릴랙신, 옥시토신)를 생성하고 작은 세포보다 아로마타제 활성이 더 크고 프로게스테론 합성이 더 활발하여 스테로이드 생성이 더 활발합니다.
프로게스테론의 최고치는 LH 최고치 후 8일째에 나타납니다. 프로게스테론과 에스트라디올은 황체기에 LH의 박동성 분비와 관련하여 간헐적으로 분비되는 것으로 나타났습니다. 황체 형성과 함께 인히빈 생성 조절은 FSH에서 LH로 전환됩니다. 인히빈은 LH 최고치 이전에 에스트라디올 증가와 함께 증가하고, LH 최고치 이후에도 에스트로겐 수치는 감소하지만 계속 증가합니다. 인히빈과 에스트라디올은 과립세포에서 분비되지만, 서로 다른 경로에 의해 조절됩니다. 황체기 말기에 인히빈이 감소하면 다음 주기의 FSH 증가에 기여합니다.
황체는 배란 후 9~11일째에 매우 빠르게 감소합니다.
퇴화 기전은 불분명하며, 자궁내막에서 관찰되는 에스트로겐의 황체용해 작용이나 수용체 관련 기전과는 관련이 없습니다. 황체에서 생성되는 에스트로겐의 역할에 대한 또 다른 설명이 있습니다. 에스트로겐은 자궁내막에서 프로게스테론 수용체 합성에 필요한 것으로 알려져 있습니다. 황체기 에스트로겐은 배란 후 자궁내막에서 프로게스테론 관련 변화에 필수적일 가능성이 높습니다. 에스트로겐 수치 부족으로 인한 프로게스테론 수용체의 발달 부족은 불임 및 초기 임신 유산의 또 다른 기전일 수 있으며, 이는 황체기 결핍의 또 다른 형태입니다. 황체의 수명은 배란 시점에 결정된다고 여겨지며, 임신으로 인해 인간 융모성 성선자극호르몬의 지원을 받지 못하면 확실히 퇴화될 것입니다. 따라서 황체의 퇴행은 에스트라디올, 프로게스테론, 그리고 인히빈 수치의 감소로 이어집니다. 인히빈 수치가 감소하면 FSH에 대한 억제 효과가 사라지고, 에스트라디올과 프로게스테론 수치가 감소하면 GnRH 분비가 매우 빠르게 회복되고 뇌하수체로부터의 피드백 기전이 사라집니다. 인히빈과 에스트라디올 수치가 감소하고 GnRH 수치가 증가하면 LH보다 FSH가 더 많이 분비됩니다. FSH 수치가 증가하면 난포가 성장하여 우성 난포가 선택되고, 임신이 이루어지지 않으면 새로운 주기가 시작됩니다. 스테로이드 호르몬은 생식 생물학 및 일반 생리학에서 중요한 역할을 합니다. 스테로이드 호르몬은 인간의 표현형을 결정하고, 심혈관계, 뼈 대사, 피부, 전반적인 건강에 영향을 미치며, 임신에 중요한 역할을 합니다. 스테로이드 호르몬의 작용은 세포핵으로 세포 외 신호를 전달하여 생리적 반응을 유발하는 데 필요한 세포 내 및 유전적 기전을 반영합니다.
에스트로겐은 세포막을 광범위하게 침투하여 세포핵에 위치한 수용체에 결합합니다. 수용체-스테로이드 복합체는 DNA에 결합합니다. 표적 세포에서 이러한 상호작용은 유전자 발현, 단백질 합성, 그리고 특정 세포 및 조직 기능을 유발합니다.
Использованная литература



 [
[